生体内で遺伝子の発現を時間的・空間的に制御する
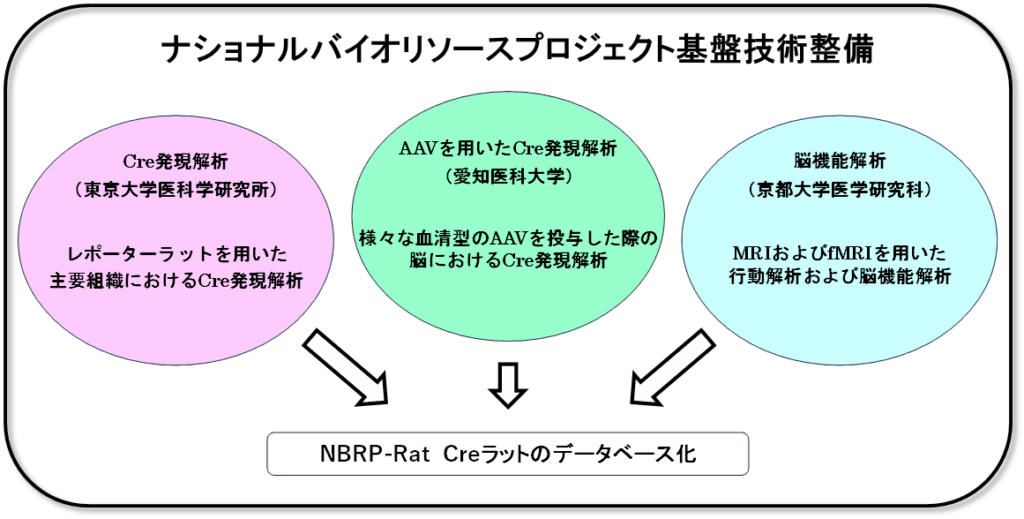
Creドライバーラットは、Cre-loxPシステムを利用した組織・時期特異的な遺伝子発現制御を可能にし、幅広い分野の研究に貢献します。NBRP-RatではCreドライバーラットの安定した提供とともに、基盤技術整備事業として、品質の向上を目的に、Creドライバーラットに網羅的、局所的なCre発現解析や行動異常の有無を評価する機能的解析を行い、系統情報としてデータベース化するプロジェクトを進めています。
Creドライバーラット【Creラットデータベース(NBRP-CRDIMS)】
研究者のニーズに応じた系統を増やしながら、Creラットデータベース(NBRP-CRDIMS)を作製しています。
| NBRP-Rat No. | 系統名 | 主な発現部位 | Tg or KI | 論文 | 発現解析* | AAV発現解析* | 行動解析* | 所属機関名 | 研究責任者 | 保存状況 | 備考 |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 0283 | W-Tg(CAG-cre)81Jmsk | 全身性(骨格筋に高発現) | Tg | Uchimura Y, 2024. Miyasaka Y, 2018. Fukamachi K, 2013. Sato Y, 2004. Haijima A, 2026. | Hot plate test, PPI, Open field test, Fear conditioning, MRI | 自治医科大学分子病態治療研究センター | 小林 英司 | 胚、精子、生体 | |||
| 0778 | W-Tg(HCRT-cre,-EGFP)B5Ahky | 脳(オレキシン神経) | Tg | Dergacheva O, 2016. | 名古屋大学 | 山中 章弘 | 精子 | ||||
| 0839 | W-Tg(Slc32a1-cre)3_5Fusa | 脳(VGAT陽性神経) | Tg | Soma S, 2019. Sugimoto M, 2021. | 東京慈恵会医科大学 | 加藤 総夫 | 精子 | 提供実績あり | |||
| 0843 | LE-Tg(Drd2-cre)487-3Koba | 脳 | Tg | Nonomura S, 2018. | 福島県立医科大学医学部 | 小林 和人 | 精子 | ||||
| 0853 | LE-Tg(Pvalb-cre)2-28Koba | 脳(GABA駆動性介在神経細胞) | Tg | Oh YM, 2017. | 福島県立医科大学医学部 | 小林 和人 | 精子、生体 | ||||
| 0856 | W-Tg(Dbh-tTA,-cre)2_7Fusa | 脳(ドパミンβ水酸化酵素陽性神経細胞) | Tg | 東京慈恵会医科大学 | 加藤 総夫 | 精子 | 提供実績あり | ||||
| 0875 | W-Tg(Slc32a1-cre)1_4Fusa | 脳(VGAT陽性神経) | Tg | Soma S, 2019. | 東京慈恵会医科大学 | 加藤 総夫 | 精子 | ||||
| 0876 | W-Tg(Slc32a1-cre)2_5Fusa | 脳(VGAT陽性神経) | Tg | Soma S, 2019. | 東京慈恵会医科大学 | 加藤 総夫 | 精子 | ||||
| 0877 | W-Tg(Slc32a1-cre)5_9Fusa | 脳(VGAT陽性神経) | Tg | Soma S, 2019. | 東京慈恵会医科大学 | 加藤 総夫 | 精子 | ||||
| 0878 | W-Tg(Dbh-tTA,-cre)5_4Fusa | 脳(ドパミンβ水酸化酵素陽性神経細胞) | Tg | 東京慈恵会医科大学 | 加藤 総夫 | 精子 | |||||
| 0879 | W-Tg(Dbh-tTA,-cre)5_9Fusa | 脳(ドパミンβ水酸化酵素陽性神経細胞) | Tg | 東京慈恵会医科大学 | 加藤 総夫 | 精子 | |||||
| 0893 | LE-Tg(Tac1-cre)6-7Koba | 脳(線条体投射神経細胞) | Tg | Nonomura S, 2018. | 福島県立医科大学医学部 | 小林 和人 | 精子 | ||||
| 0900 | LE-Tg(Tac1-cre)4-1Koba | 脳(線条体投射神経細胞) | Tg | Nonomura S, 2018. Haijima A, 2026. | 線条体D1細胞 | 福島県立医科大学医学部 | 小林 和人 | 精子、生体 | 継続して提供実績あり | ||
| 0908 | LE-Tg(Pdyn-cre)2-9Koba | 脳(ダイノルフィン神経) | Tg | 福島県立医科大学医学部 | 小林 和人 | 精子 | |||||
| 0931 | LE-Pvalbem2(T2A-cre)Koba | 脳(GABA駆動性介在神経細胞) | KI | Yoshimi K, 2021. Matsushita N, 2023. Haijima A, 2026. | 介在ニューロン、線条体、Pvニューロンでのみ発現 | Hot plate test, PPI, Open field test, Fear conditioning, MRI | 福島県立医科大学医学部 | 小林 和人 | 精子 | ||
| 0976 | LE-Tg(Drd2-cre)490-9Koba | 脳 | Tg | Nonomura S, 2018. Haijima A, 2026. | 線条体D2細胞 | 福島県立医科大学医学部 | 小林 和人 | 精子 | 継続して提供実績あり | ||
| 0982 | LE-Sstem1(cre)Bfdi | 脳 | KI | 大脳皮質、海馬で非Sst細胞に発現 | 兵庫医科大学 | 崔 翼龍 | 精子 | ||||
| 0991 | LE-Them1(cre)Koba | 脳 | KI | 福島県立医科大学医学部 | 小林 和人 | 精子 | ssODNノックイン、プラスミドDNAが挿入されている | ||||
| 0992 | LE-Them2-1(cre)Koba | 脳 | KI | Yoshimi K, 2021. Matsushita N, 2022. Haijima A, 2026. | 線条体D1細胞 | Hot plate test, PPI, Open field test, Fear conditioning, MRI | 福島県立医科大学医学部 | 小林 和人 | 精子 | 1塩基挿入T、継続して提供実績あり | |
| 0993 | LE-Them2-2(cre)Koba | 脳 | KI | Yoshimi K, 2021. Matsushita N, 2022. | 嗅球、中脳、脳梁 | Hot plate test, PPI, Open field test, Fear conditioning, MRI | 福島県立医科大学医学部 | 小林 和人 | 精子 | 1塩基挿入A | |
| 0994 | F344-Albem4(cre)Larc | 肝臓 | KI | Ishida S, 2025. | 肝臓 | 東北大学 | 山本 雅之 | 精子、生体 | |||
| 0997 | F344-Rosa26em10(Alb-cre)Larc | 全身性 | KI | Ishida S, 2025. | 肝臓(全身にリーク) | 東北大学 | 山本 雅之 | 精子 | |||
| 0998 | LE-Calcbem1(cre)Lphmc | 脳 | KI | 兵庫医科大学 | 神田 浩里 | 精子 | |||||
| 0999 | W-Gpr65em2(cre)Larc | 脳 | KI | 産総研 | 釣木澤 朋和 | 胚、精子 | |||||
| 1000 | SD-Tg(Thy1-cre)18Larc | 脳(大脳皮質神経細胞) | Tg | 脳(大脳皮質神経細胞) | 東京大学 | 真下 知士 | 精子、生体 | ||||
| 1007 | LE-Adora2aem8(cre)Larc | 脳 | KI | 滋賀医科大学 | 野々村 聡 | 精子、生体 | |||||
| 1010 | F344-Rosa26em5(EF1A-cre)Larc | 全身性 | KI | 東京大学 | 真下 知士 | 精子、生体 | |||||
| 1012 | F344-Rosa26em20(Alb-cre)Larc | 肝臓 | KI | Ishida S, 2025. | 肝臓 | 東北大学 | 山本 雅之 | 精子、生体 | |||
| 1014 | LE-Tg(Tac1-cre)3-2Koba | 脳(線条体投射神経細胞) | Tg | Nonomura S, 2018. | 福島県立医科大学医学部 | 小林 和人 | 精子 | ||||
| 1038 | F344-Rosa26em5(CAG-cre)Larc | 全身性 | KI | 東京大学 | 真下 知士 | 生体 | |||||
| 1039 | F344-Rosa26em2(CAG-cre/ERT2)Larc | 全身性 | KI | 東京大学 | 真下 知士 | 生体 | |||||
| 1040 | F344.SD-Tg(Thy1-cre)18Larc | 脳(大脳皮質神経細胞) | Tg | Haijima A, 2026. | 東京大学 | 真下 知士 | 生体 |
*解析結果のリンク作成中です
レポーターラット
| NBRP-Rat No. | 系統名 | 主な発現部位 | Tg or KI | 論文 | 発現解析* | AAV発現解析* | 行動解析* | 所属機関名 | 研究責任者 | 保存状況 | 備考 |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 1008 | F344-Rosa26em11(CAG-EGFP,-mCherry)Larc | 全身性 | KI | Ishida S, 2025. | 東京大学 | 真下 知士 | 精子 |
*解析結果のリンク作成中です
実用化例

論文リスト
Functional behavioral profiling of multiple cre-driver rat lines.*NEW*
Haijima A, Imai H, Matsushita N, Morita K, Kobayashi K, Ishida S, Iida R, Mashimo T, Asano M.
Exp Anim. 2026 Jan 9. doi: 10.1538/expanim.25-0115.
Diverse Cre recombinase expression pattern in Albumin-Cre driver rats.
Ishida S, Taguchi K, Iida R, Hattori K, Taketsuru H, Yoshimi K, Yamamoto M, Mashimo T.
Exp Anim. 2025 Jan 22. doi: 10.1538/expanim.24-0174.
Opioidergic activation of the descending pain inhibitory system underlines placebo analgesia. Neyama H, Wu Y, Nakaya Y, Kato S, Shimizu T, Tahara T, Shigeta M, Inoue M, Miyamichi K, Matsushita N, Mashimo T, Miyasaka Y, Dai Y, Noguchi K, Watanabe Y, Kobayashi M, Kobayashi K, Cui Y.
Sci Adv. 2025 Jan 17;11(3):eadp8494. doi: 10.1126/sciadv.adp8494. Epub 2025 Jan 15.
Knockout of the orphan membrane transporter Slc22a23 leads to a learn and hyperactive phenotype with a small hippocampal volume. Uchimura Y, Hino K, Hattori K, Kudo Y, Owada A, Kimura T, Sugawara L, Kume S, Bellier JP, Yanagisawa D, Shiino A, Nakayama T, Daigo Y, Mashimo T, Udagawa J.
PLoS One. 2024 Aug 28;19(8):e0309461.
Protocol for highly selective transgene expression through the flip-excision switch system by using a unilateral spacer sequence in rodents. Matsushita N, Kato S, Nishizawa K, Sugawara M, Takeuchi K, Miyasaka Y, Mashimo T, Kobayashi K.
STAR Protoc. 2023 Dec 15;4(4):102667. doi: 10.1016/j.xpro.2023.102667. Epub 2023 Oct 31.
Catecholaminergic cell type-specific expression of Cre recombinase in knock-in transgenic rats generated by the Combi-CRISPR technology.
Matsushita N, Nishizawa K, Kato S, Iguchi Y, Fukabori R, Takeuchi K, Miyasaka Y, Mashimo T, Kobayashi K.
J Neurosci Methods. 2022 Nov 1;381:109707. doi: 10.1016/j.jneumeth.2022.109707. Epub 2022 Sep 9.
Active role of the central amygdala in widespread mechanical sensitization in rats with facial inflammatory pain.
Sugimoto M, Takahashi Y, Sugimura YK, Tokunaga R, Yajima M, Kato F.
Pain. 2021 Aug 1;162(8):2273-2286. doi: 10.1097/j.pain.0000000000002224.
Combi-CRISPR: combination of NHEJ and HDR provides efficient and precise plasmid-based knock-ins in mice and rats.
Yoshimi K, Oka Y, Miyasaka Y, Kotani Y, Yasumura M, Uno Y, Hattori K, Tanigawa A, Sato M, Oya M, Nakamura K, Matsushita N, Kobayashi K, Mashimo T.
Hum Genet. 2021 Feb;140(2):277-287. doi: 10.1007/s00439-020-02198-4.
Ipsilateral-Dominant Control of Limb Movements in Rodent Posterior Parietal Cortex.
Soma S, Yoshida J, Kato S, Takahashi Y, Nonomura S, Sugimura YK, Ríos A, Kawabata M, Kobayashi K, Kato F, Sakai Y, Isomura Y.
J Neurosci. 2019 Jan 16;39(3):485-502.
Monitoring and Updating of Action Selection for Goal-Directed Behavior through the Striatal Direct and Indirect Pathways.
Nonomura S, Nishizawa K, Sakai Y, Kawaguchi Y, Kato S, Uchigashima M, Watanabe M, Yamanaka K, Enomoto K, Chiken S, Sano H, Soma S, Yoshida J, Samejima K, Ogawa M, Kobayashi K, Nambu A, Isomura Y, Kimura M.
Neuron. 2018 Sep 19;99(6):1302-1314.e5. doi: 10.1016/j.neuron.2018.08.002. Epub 2018 Aug 23. PMID: 30146299.
CLICK: one-step generation of conditional knockout mice.
Miyasaka Y, Uno Y, Yoshimi K, Kunihiro Y, Yoshimura T, Tanaka T, Ishikubo H, Hiraoka Y, Takemoto N, Tanaka T, Ooguchi Y, Skehel P, Aida T, Takeda J, Mashimo T.
BMC Genomics. 2018 May 2;19(1):318.
Using a novel PV-Cre rat model to characterize pallidonigral cells and their terminations.
Oh YM, Karube F, Takahashi S, Kobayashi K, Takada M, Uchigashima M, Watanabe M, Nishizawa K, Kobayashi K, Fujiyama F.
Brain Struct Funct. 2017 Jul;222(5), 2359-2378.
Hypoxia and hypercapnia inhibit hypothalamic orexin neurons in rats.
Dergacheva O, Yamanaka A, Schwartz AR, Polotsky VY, Mendelowitz D.
J Neurophysiol. 2016 Nov 1;116(5):2250-2259. doi: 10.1152/jn.00196.2016. Epub 2016.
A novel reporter rat strain that expresses LacZ upon Cre‐mediated recombination.
Fukamachi K, Tanaka H, Sakai Y, Alexander DB, Futakuchi M, Tsuda H, Suzui M.
Genesis. 2013 Apr;51(4):268-274.
Establishment of Cre/LoxP recombination system in transgenic rats.
Sato Y, Endo H, Ajiki T, Hakamata Y, Okada T, Murakami T, Kobayashi E.
Biochem Biophys Res Commun. 2004 9;319(4):1197-1202.